1. CLASIFICACIÓN DE LA MATERIA.
ACTIVIDADES.
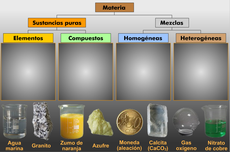
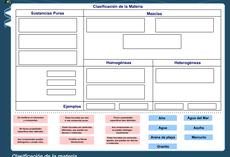
Repasa lo aprendido en el aula sobre los tipos de materia.
2. MEZCLAS HOMOGÉNEAS.
RECUERDA: Todas las mezclas formadas por metales se denominan aleaciones.
Ejemplo: bronce que es una mezcla de cobre y estaño.
ACTIVIDAD: Busca tres ejemplos de aleaciones e indica cuáles son sus componentes.
DISOLUCIONES.

Las disoluciones son mezclas homogéneas en las que se diferencian dos componentes. Uno mayoritario denominado disolvente y otro minoritario llamado soluto.
A continuación tenéis una animación para entender que sucede cuando el soluto (sal) entra en contacto con el disolvente (agua).
ACTIVIDAD: En los siguientes casos indica cuál es el soluto y cuál el disolvente.
a) Café con leche.
b) Agua azucarada.
c) Vaso de colacao.
d) Agua marina.
ACTIVIDAD: Busca información de cómo
influye la temperatura en el proceso de disolución.
¿Cómo influye la temperatura en el proceso de disolución?
* El proceso de disolución de un sólido en líquido se ve favorecido por el incremento de temperatura.
* La disolución de un gas en líquido se ve disminuida si aumenta la temperatura.
TIPOS DE DISOLUCIONES.
Las disoluciones se clasifican en:
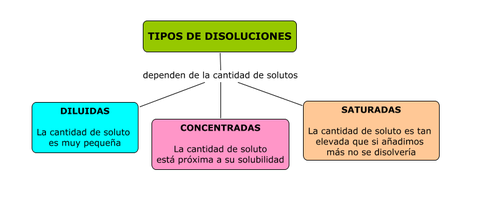
ACTIVIDAD: La solubilidad del cloruro de sodio en el agua a 20ºC es de 36 g. ¿Podemos disolver 20 g de sal en 50 g de agua?¿Y en 60 g de agua?¿Qué tipo de disolución
obtendríamos?
¿Qué es la concentración de una disolución?
Es la cantidad de soluto que hay disuelta en una determinada cantidad de disolvente.
Puede expresarse en tanto por ciento en masa que es la masa de soluto (gramos) que hay en 100 g de disolución.
% en masa del soluto= (masa de soluto/ masa de disolución) x 100
ACTIVIDAD: Calcula la concentración en porcentaje de masa (% de masa) de sal en una disolución que tiene 6 g de sal disueltos en 150 g de agua.
ACTIVIDAD: Calcula la concentración de azúcar (% de masa) cuando se disuelven 10 g de azúcar en 90 g de agua.
ACTIVIDAD: Indica qué disolución es más concentrada, una que se prepara disolviendo 10 g de sal en 100 g de agua o una que se prepara disolviendo 5 g de sal en 20 g de
agua.
a) Calcula las concentraciones de ambas disoluciones.
ACTIVIDAD: La concentración de una disolución de sal en agua es del 5% en masa. ¿Qué cantidad de soluto habrá en 600 g de disolución?
3. MÉTODOS PARA SEPARAR MEZCLAS.
ACTIVIDADES
4. EL ÁTOMO.
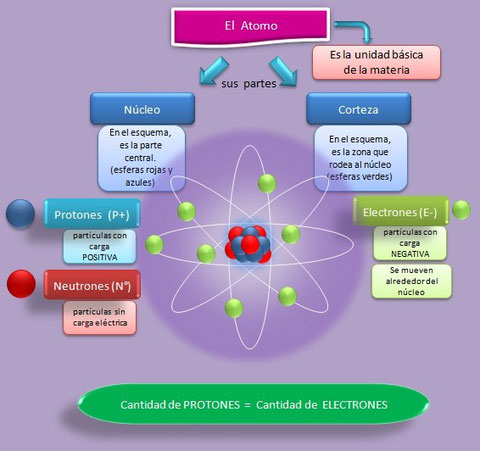
La materia está formada por una partículas muy pequeñas llamadas átomos.
Los átomos podemos diferenciar dos zonas:
1. Núcleo: zona central del átomo en la que encontramos protones (partículas subatómicas con carga positiva) y neutrones (sin carga eléctrica).
2. Corteza: zona más externa del átomo en la que se localizan los electrones (carga negativa) girando alrededor del núcleo en diversas órbitas.
El número de protones y electrones es el mismo de manera que las cargas están equilibradas.

Cada átomo que hay en la naturaleza es un elemento químico que se representa mediante un símbolo y presentan un número atómico (Z) que representa el número de
protones.
Los elementos químicos están agrupados en el Sistema Periódico.
5. LAS SUSTANCIAS PURAS.
Las sustancias puras están formadas por la agrupación de átomos y se representan por unas fórmulas químicas.
En la fórmula química escribimos los símbolos de todos los elementos que contiene la sustancia acompañados de subíndices, que expresan el número de átomos de cada elemento.

Podemos encontrar sustancias puras de varios clases:
1. Sustancias atómicas cuya unidad elemental es el átomo que puede encontrarse libre (He) o formar una red cristalina por la unión de átomos (Fe).
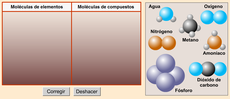
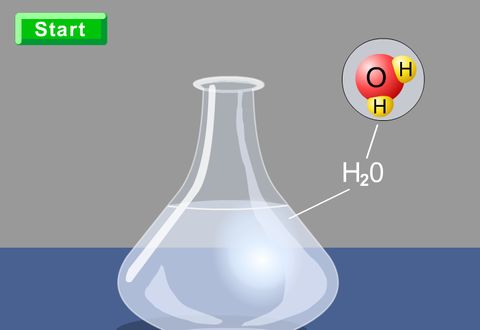
2. Sustancias moleculares formadas por la unión de átomos del mismo o diferentes elementos (H2O).
3. Sustancias iónicas formadas por la unión de iones formando una red cristalina. Un ión es un átomo que ha ganado o perdido electrones. Si los gana forma un ion
negativo, y si los pierde, uno positivo.
6. ELEMENTOS QUÍMICOS.

En la imagen se indican cuáles son los elementos químicos más abundantes en la corteza terrestre.
Busca información sobre los elementos químicos más abundantes en los seres vivos e indica cuáles de ellos se encuentran en mayor proporción en seres vivos y materia inerte.
ACTIVIDAD
 E.S.O
CIENCIAS
E.S.O
CIENCIAS